|
第三节 内质网
由KR. Porter、A. Claude 和 EF. Fullam等人于1945年发现,他们在观察培养的小鼠成纤维细胞时,发现细胞质内部具有网状结构,建议叫做内质网endoplasmic reticulum,ER,后来发现内质网不仅仅存在于细胞的“内质”部,通常还有质膜和核膜相连,并且与高尔基体关系密切,并且常伴有许多线粒体。
一、形态与组成
内质网膜约占细胞总膜面积的一半,是真核细胞中最多的膜。内质网是内膜构成的封闭的网状管道系统。具有高度的多型性。可分为粗面型内质网(rough endoplasmic reticulum,RER,图6-20)和光面型内质网(smooth endoplasmic reticulum,SER,图6-21)两类。RER呈扁平囊状,排列整齐,膜围成的空间称为ER腔(lumen),膜外有核糖体附着。SER呈分支管状或小泡状,无核糖体附着。肌肉细胞中的肌质网是一种特化的SER,称为肌质网,可贮存Ca2+,引起肌肉收缩。细胞不含纯粹的RER或SER,它们分别是ER连续结构的一部分。
ER主要功能是合成蛋白质和脂类,分泌性蛋白和跨膜蛋白都是在ER中合成的。ER合成的脂类除满足自身需要外,还提供给高尔基体、溶酶体、内体、质膜、线粒体、叶绿体等膜性细胞结构。
ER膜中含大约60%的蛋白和40%的脂类,脂类主要成分为磷脂,磷脂酰胆碱含量较高,鞘磷脂含量较少,没有或很少含胆固醇。ER约有30多种膜结合蛋白,另有30多种位于内质网腔,这些蛋白的分布具有异质性,如:葡糖-6-磷酸酶,普遍存在于内质网,被认为是标志酶,核糖体结合糖蛋白(ribophorin)只分布在RER,P450酶系只分布在SER。
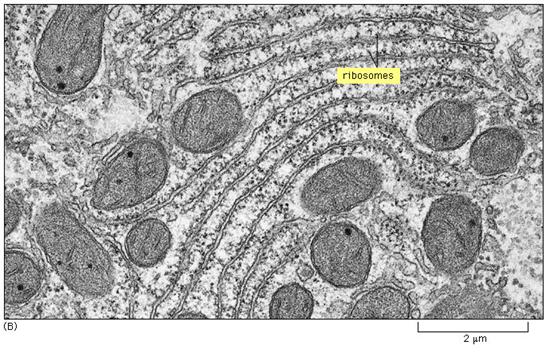
图6-20 RER的形态
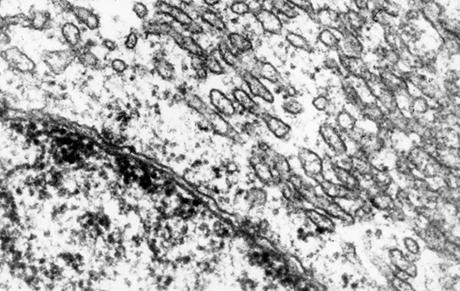
图6-21 SER的形态 引自http://www.uni-mainz.de
二、RER的功能
(一)蛋白质合成
蛋白质都是在核糖体上合成的,并且起始于细胞质基质,但是有些蛋白质在合成开始不久后便转在内质网上合成,这些蛋白质主要有:①向细胞外分泌的蛋白、如抗体、激素;②跨膜蛋白,并且决定膜蛋白在膜中的排列方式;③需要与其它细胞组合严格分开的酶,如溶酶体的各种水解酶;④需要进行修饰的蛋白,如糖蛋白。
C. Milstein(1972)发现从骨髓瘤细胞提取的免疫球蛋白分子N端要比分泌到细胞外的N端多出一段。G. Blobel和D. Sabatini等根据进一步的实验,提出了信号假说(Signal hypothesis),认为蛋白质上的信号肽,指导蛋白质转至内质网上合成。Blobel因此项发现获1999年诺贝尔生理医学奖。
蛋白质转入内质网合成至少涉及5种成分:
①信号肽(signal peptide),是引导新合成肽链转移到内质网上的一段多肽,位于新合成肽链的N端,一般16~30个氨基酸残基,含有6-15个带正电荷的非极性氨基酸,由于信号肽又是引导肽链进入内质网腔的一段序列,又称开始转移序列(start transfer sequence)。
②信号识别颗粒(signal recognition particle,SRP),由6种结构不同的多肽组成,结合一个7S RNA,分子量325KD,属于一种核糖核蛋白(ribonucleoprotein)。SRP与信号序列结合,导致蛋白质合成暂停。
③ SRP受体(SPR
receptor),是膜的整合蛋白,为异二聚体蛋白,存在于内质网上,可与SRP特异结合。
④停止转移序列(stop transfer sequence),肽链上的一段特殊序列,与内质网膜的亲合力很高,能阻止肽链继续进入内质网腔,使其成为跨膜蛋白质。
⑤转位因子(translocator),由3-4个Sec61蛋白复合体构成的一个类似炸面圈的结构,每个Sec61蛋白由三条肽链组成。
蛋白质转入内质网合成的过程:
信号肽与SRP结合→肽链延伸终止→SRP与受体结合→SRP脱离信号肽→肽链在内质网上继续合成,同时信号肽引导新生肽链进入内质网腔→信号肽切除→肽链延伸至终止→翻译体系解散。这种肽链边合成边向内质网腔转移的方式,称为co-translation(图6-22)。
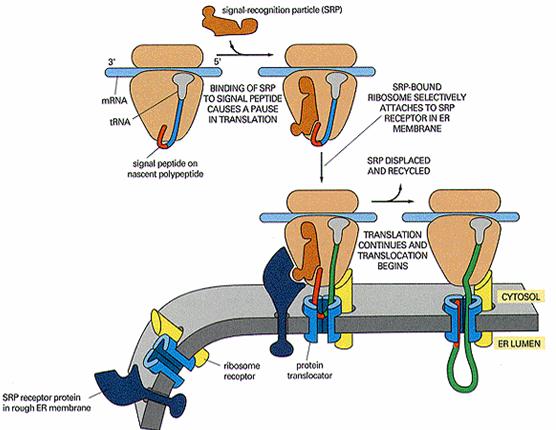
图6-22 蛋白质转移到内质网上合成的过程
表3 一些信号肽序列
|
蛋白质 |
信号序列 |
|
Preproalbumin |
Met-Lys-Trp-Val-Thr-Phe-Leu-Leu-Leu-Leu-Phe-Ile-Ser-
Gly-Ser-Ala-Phe-Ser↓Arg... |
|
Pre-IgG light chain |
Met-Asp-Met-Arg-Ala-Pro-Ala-Gln-Ile-Phe-Gly-Phe-Leu-
Leu-Leu-Leu-Phe-Pro-Gly- Thr-Arg-Cys↓Asp... |
|
Prelysozyme |
Met-Arg-Ser-Leu-Leu-Ile-Leu-Val-Leu-Cys-Phe-Leu-
Pro-Leu-Ala-Ala-Leu-Gly↓Lys... |
(二)蛋白质的修饰与加工
包括糖基化、羟基化、酰基化、二硫键形成等,其中最主要的是糖基化,几乎所有内质网上合成的蛋白质最终被糖基化。糖基化的作用是: ①使蛋白质能够抵抗消化酶的作用;②赋予蛋白质传导信号的功能;③某些蛋白只有在糖基化之后才能正确折叠。
糖基一般连接在4种氨基酸上,分为2种:
O-连接的糖基化(O-linked glycosylation):与Ser、Thr和Hyp的OH连接,连接的糖为半乳糖或N-乙酰半乳糖胺,在高尔基体上进行O-连接的糖基化。
N-连接的糖基化(N-linked glycosylation):与天冬酰胺残基的NH2连接,糖为N-乙酰葡糖胺(图6-23)。
内质网上进行的为N-连接的糖基化。糖的供体为核苷糖(nucleotide sugar),如CMP-唾液酸、GDP-甘露糖、UDP-N-乙酰葡糖胺等。糖分子首先被糖基转移酶转移到膜上的磷酸长醇(dolichol phosphate)分子上,装配成寡糖链。再被寡糖转移酶转到新合成肽链特定序列(Asn-X-Ser或Asn-X-Thr)的天冬酰胺残基上。
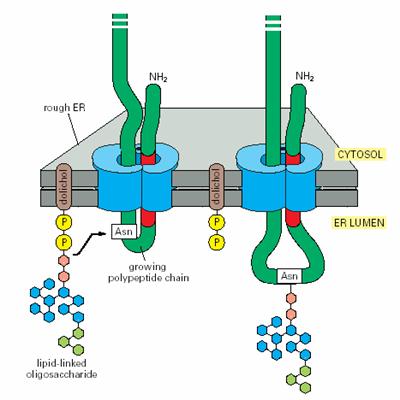
图6-23 N-连接的糖基化 引自Molecular
Biology of the Cell. 4th ed. 2002
(三)新生肽链的折叠、组装和运输
COP II介导由内质网输出的膜泡运输,这种膜泡由内质网的排出位点(exit sites)以出芽的方式排出,内质网的排出位点没有结合核糖体,随机分布在内质网上。不同的蛋白质在内质网腔中停留的时间不同,主要取决于蛋白质完成正确折叠和组装的时间,这一过程是在属于hsp70家族的ATP酶的作用下完成的,需要消耗能量。有些无法完成正确折叠的蛋白质被输出内质网,转入溶酶体中降解掉,大约90%的新合成的T细胞受体亚单位和乙酰胆碱受体都被降解掉,而从未到达靶细胞膜。
三、ER的其它功能
合成膜脂:大多数膜只是完全在内质网中合成的,例外的情况包括:①鞘磷脂是在内质网上开始合成的,但完成于高尔基体;②某些线粒体和叶绿体独有的膜脂是驻留在这些细胞器中的酶催化合成的。ER合成的膜脂以膜跑运输的方式转运至高尔基体,溶酶体和质膜上,或借磷脂转移蛋白(phospholipid transfer protein,PTP)形成水溶性复合物,转至其他膜上。
解毒作用:SER中的P450酶系属于单加氧酶(monooxygenase),又称为多功能氧化酶 (mixed function oxidase)、羟化酶(hydroxylase),因其还原态的吸收峰在450nm处,故名。主要分布在SER中,但也存在于质膜、线粒体、高尔基体、过氧化物酶体、核膜等细胞器的膜中,具有解毒作用,通常可将脂溶性有毒物质,代谢为水溶性物质,使有毒物质排出体外。有时也会将致癌物代谢为活性致癌物。P450种类繁多,但都是与其他辅助成分组成一个呼吸链来实现其功能,呼吸链中的P450还原酶实际就是一种黄素蛋白。P450催化O2分子中的一个原子加到底物分子上使之羟化,另一个氧原子被NADH或NADPH提供的氢还原生成水,在此氧化过程中无高能磷酸化合物生成。
甾体类激素的合成:在生殖腺和肾上腺的内分泌细胞中,SER、线粒体,可能还有高尔基体上的一些酶共同参与甾体类激素的合成。
调节血糖浓度:使葡糖6-磷酸水解为磷酸和葡萄糖,释放糖至血液中。细胞中的糖元可被酶转化为葡糖1-磷酸,再转变为葡糖6-磷酸,但由于膜对磷酸化的糖是高度不通透的,葡糖6-磷酸只有在去磷酸化以后才能通过质膜,进入血液。
形成一些特殊结构:如肌细胞中的SER特化成的肌质网可储存钙离子,作为细胞内信号物质。
支撑作用:内质网是细胞内最丰富的膜,形成了一种网络结构,提供机械支撑作用,并成为细胞质中酶附着的支架。
|