|
第二节 膜泡运输
细胞内部内膜系统各个部分之间的物质传递常常通过膜泡运输方式进行。如从内质网到高尔基体;高尔基体到溶酶体;细胞分泌物的外排,都要通过过渡性小泡进行转运。膜泡运输是一种高度有组织的定向运输,各类运输泡之所能够被准确地运到靶细胞器,主要是因为细胞器的胞质面具有特殊的膜标志蛋白。许多膜标志蛋白存在于不止一种细胞器,可见不同的膜标志蛋白组合,决定膜的表面识别特征。
大多数运输小泡是在膜的特定区域以出芽的方式产生的。其表面具有一个笼子状的由蛋白质构成的衣被(coat)。这种衣被在运输小泡与靶细胞器的膜融合之前解体。衣被具有两个主要作用:①选择性的将特定蛋白聚集在一起,形成运输小泡;②如同模具一样决定运输小泡的外部特征,相同性质的运输小泡之所以具有相同的形状和体积,与衣被蛋白的组成有关。
胞内膜泡运输沿微管或微丝运行,动力来自马达蛋白(motor proteins)。与膜泡运输有关的马达蛋白有3类:一类是动力蛋白(dynein),可向微管负端移动;另一类为驱动蛋白(kinesin),可牵引物质向微管的正端移动;第三类是肌球蛋白(myosin),可向微丝的正极运动。在马达蛋白的作用下,可将膜泡转运到特定的区域,
一、衣被类型
已知三类具有代表性的衣被蛋白,即:笼形蛋白(clathrin)、COPI和COPII,个介导不同的运输途径(表2)。
表2 衣被小泡的类型与功能
|
衣被类型 |
GTP酶 |
组成与衔接蛋白 |
运输方向 |
|
clathrin |
Arf |
Clathrin重链与轻链,AP2 |
质膜→内体 |
|
Clathrin重链与轻链,AP1 |
高尔基体→内体 |
|
Clathrin重链与轻链,AP3 |
高尔基体→溶酶体
高尔基体→植物液泡 |
|
COP
I |
Arf |
COPαββ’γδεζ |
高尔基体→内质网 |
|
COP
II |
Sar
1 |
Sec23/Sec24复合体,Sec 13/31复合体, Sec 16,Sec 12 |
内质网→高尔基体 |
(一)笼形蛋白衣被小泡
笼形蛋白衣被小泡是最早发现的衣被小泡,介导高尔基体到内体、溶酶体、植物液泡的运输,以及质膜到内膜区隔的膜泡运输。
笼形蛋白分子由3个重链和3个轻链组成(图6-2),形成一个具有3个曲臂的形状(triskelion)。许多笼形蛋白的曲臂部分交织在一起,形成一个具有5边形网孔的笼子(图6-3)。
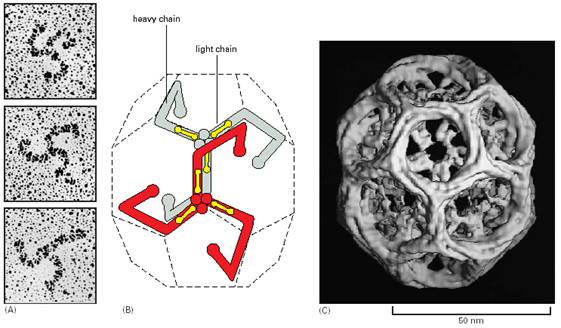
图6-2 笼形蛋白的结构,A电镜照片,B分子模型,C衣被模型 引自Molecular
Biology of the Cell. 4th ed. 2002
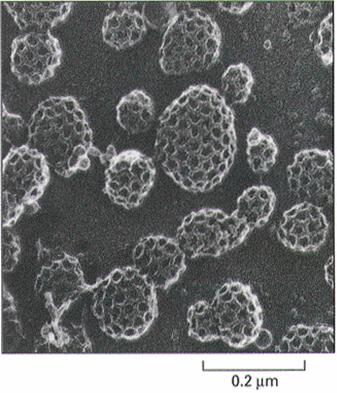
图6-3 笼形蛋白衣被小泡的形态
笼形蛋白形成的衣被中还有衔接蛋白(adaptin)。它介于笼形蛋白与配体受体复合物之间,起连接作用(图6-4)。目前至少发现4种不同类型的衔接蛋白,可分别结合不同类型的受体,形成不同性质的转运小泡,如AP1参与高尔基体→内体的运输、AP2参与质膜→内体的运输、AP3参与高尔基体→溶酶体的运输。
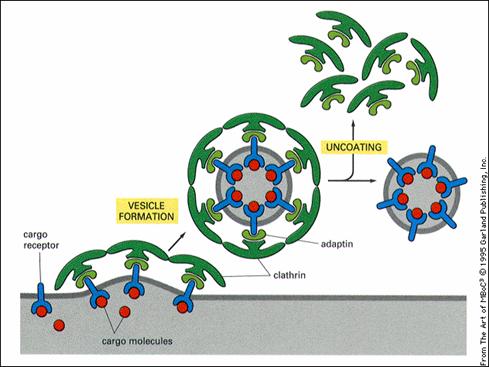
图6-4 笼形衣被小泡的组成
当笼形蛋白衣被小泡形成时,可溶性蛋白动力素(dynamin)聚集成一圈围绕在芽的颈部(图6-5),将小泡柄部的膜尽可能地拉近(小于1.5nm),从而导致膜融合,掐断(pinch
off)衣被小泡。动力素是一种GTP酶,调节小泡以出芽形式脱离膜的速率。动力素可以召集其它可溶性蛋白在小泡的颈部聚集,通过改变膜的形状和膜脂的组成,促使小跑颈部的膜融合,形成衣被小泡。
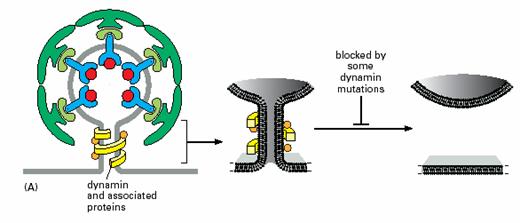
图6-5
Clathrin衣被小泡的掐断过程 引自Molecular
Biology of the Cell. 4th ed. 2002
当衣被小泡从膜上释放后,衣被很快就解体,属于hsp70家族的一种分子伴侣(molecular chaperone)充当衣被解体的ATP酶,一种辅蛋白(auxillin)可以激活这种ATP酶。
(二)COP I衣被小泡
负责回收、转运内质网逃逸蛋白(escaped proteins)返回内质网(图6-6、7)。起初发现于高尔基体碎片,在含有ATP的溶液中温育时,能形成非笼形蛋白包被的小泡。进一步的研究发现这种衣被蛋白复合体包含多达7种肽链。
内质网向高尔基体输送运输小泡时,一部分自身的蛋白质也不可避免的被运送到了高尔基体,如不进行回收则内质网因为磷脂和某些蛋白质的匮乏而停止工作。内质网通过两种机制维持蛋白质的平衡 :一是转运泡将应被保留的驻留蛋白排斥在外,例如有些驻留蛋白参与形成大的复合物,因而不能被包装在出芽形成的转运泡中,结果被保留下来;二是通过对逃逸蛋白的回收机制,使之返回它们正常驻留的部位。
内质网的正常驻留蛋白,不管在腔中还是在膜上,它们在C端含有一段回收信号序列(retrieval signals),如果它们被意外地逃逸进入转运泡从内质网运至高尔基体cis面,则cis面的膜结合受体蛋白将识别并结合逃逸蛋白的回收信号,形成COPI衣被小泡将它们返回内质网。内质网腔中的蛋白,如蛋白二硫键异构酶和协助折叠的分子伴侣,均具有典型的回收信号Lys-Asp-Glu-Leu(KDEL,图6-8)。内质网的膜蛋白(如SRP受体)在C端有一个不同的回收信号,通常是Lys-Lys-X-X(KKXX,X:任意氨基酸),同样可保证它们的回收。
COP I衣被小泡还可以介导高尔基体不同区域间的蛋白质运输。
图6-6 COP I衣被小泡的形态
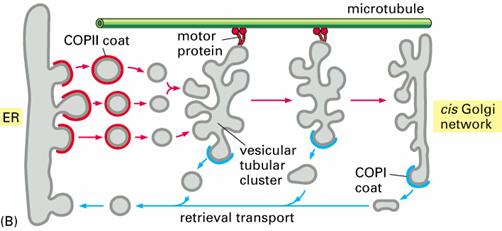
图6-7 COPI和COPII衣被小泡 引自Molecular Biology of the Cell. 4th ed. 2002
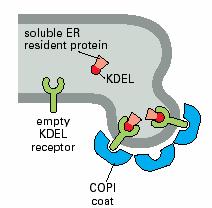
图6-8 KDEL序列 引自Molecular Biology
of the Cell. 4th ed. 2002
(三)COPⅡ衣被小泡
介导从内质网到高尔基体的物质运输。最早发现于酵母ER在ATP存在的细胞质液中温育时,ER膜上能形成类似于COP I的衣被小泡,某些温度敏感型的酵母,由于COP II衣被蛋白发生变异,在特定温度下会在内质网中积累蛋白质。
COP II衣被由多种蛋白质构成(参见表2),其中Sar1GTP酶与Sec23/Sec24复合体结合在一起,形成紧紧包围着膜的一层衣被,Sec13/Sec31复合体形成覆盖在外围的一层衣被,Sec16推测可能是一种骨架蛋白,Sec12是Sar1的鸟苷酸交换因子。真核生物的COP II衣被蛋白亚单位具有一些横向同源物(Paralog),这些同源物可能介导不同的蛋白质转运,具有不同的调节机制。在实验条件下,纯化的Sar1、Sec23/Sec24、Sec13/Sec31等5种成分足以在人工脂质体上形成小泡,说明这些成分具有改变膜的形状和掐断运输小泡的功能。
COP II衣被小泡形成与内质网的特殊部位,称为内质网出口(exit sites),这些部位没有核糖体,由交织在一起的管道和囊泡组成网络结构。
由内质网到高尔基体的蛋白转运中,大多数跨膜蛋白是直接结合在COP II衣被上,但是少数跨膜蛋白和多数可溶性蛋白通过受体与COP II衣被结合,这些受体在完成转运后,通过COP I衣被小泡返回内质网。
COP II衣被所识别的分选信号位于跨膜蛋白胞质面的结构域,形式多样,有些包含双酸性基序[DE]X[DE](D为Asp,E为Glu,X为任何一种氨基酸),如Asp-X-Glu序列,其他一些具有短的疏水基序,如FF,YYM,FY,LL,IL等等(其中F为Phe,Y为Tyr,M为Met,L为Leu,I为Ile)。
二、衣被的形成
衣被是在一类叫作衣被召集GTP酶(coat-recruitment GTPase)作用下形成的。衣被召集GTP酶通常为单体GTP酶(monomeric GTPase),也叫G蛋白,起分子开关的作用,结合GDP的形式没有活性,位于细胞质中,结合GTP而活化,转位至膜上,能与衣被蛋白结合,促进核化和组装。
G蛋白具有两类重要的调节蛋白,即:鸟苷酸交换因子(guanine-nucleotide exchange
factor, GEF)和GTP酶激活蛋白(GTPase activating protein, GAP)。GEF的作用是使G蛋白释放GDP,结合GTP而激活。GAP的作用是激活G蛋白的酶活性,使GTP水解,G蛋白失活,G蛋白本身的GTP酶活性不高。除单体G蛋白以外,三聚体G蛋白也起分子开关的作用,控制衣被小泡的形成。
衣被召集GTP酶包括Arf蛋白和Sar 1蛋白(图6-9),Arf参与高尔基体上笼形蛋白衣被与COP I衣被的形成,Sar
1参与内质网上COP II衣被的形成,两者的作用方式大体相似。质膜上笼形蛋白衣被的形成也与GTP酶有关,但其成分尚不明确。
衣被召集GTP酶大量存在于细胞质中,但处于结合GDP的失活状态。当内质网上要形成COPII衣被小泡时,Sar 1释放GDP结合GTP而激活,激活的Sar 1暴露出一条脂肪酸的尾巴,插入内质网膜,然后开始召集衣被蛋白,以衣被蛋白为模型形成运输小泡。活化的衣被召集GTP酶还可以激活磷脂酶D(phospholipase D),将一些磷脂水解,使形成衣被的蛋白质牢固地结合在膜上。
衣被召集GTP酶对衣被的形成其动态调节作用,当多数衣被召集GTP酶处于结合GTP的状态时,它催化衣被的形成;反之当多数衣被召集GTP酶处于结合GDP的状态时,它催化衣被的解体。因此衣被的形成过程是边形成便解体的动态过程,只有在组装速率大于解体速率时,才能形成衣被小泡。
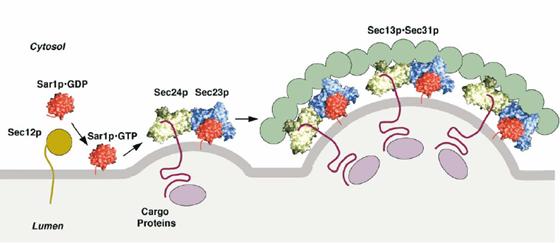
图6-9
COP II衣被小泡的组装 引自Juan S. Bonifacino等 2004
三、膜泡运输的定向机制
衣被小泡沿着细胞内的微管被运输到靶细胞器,马达蛋白水解ATP提供运输的动力。各类运输小泡之所以能够被准确地和靶膜融合,是因为运输小泡表面的标志蛋白能被靶膜上的受体识别,其中涉及识别过程的两类关键性的蛋白质是SNAREs(soluble NSF attachment protein receptor)和Rabs(targeting GTPase)。其中SNARE介导运输小泡特异性停泊和融合,Rab的作用是使运输小泡靠近靶膜。
(一)SNAREs
SNAREs的作用是保证识别的特异性和介导运输小泡与目标膜的融合,动物细胞中已发现20多种SNAREs,分别分布于特定的膜上,位于运输小泡上的叫作v-SNAREs,位于靶膜上的叫作t-SNAREs(图6-10)。v-SNAREs和 t-SNAREs都具有一个螺旋结构域,能相互缠绕形成跨SNAREs复合体(trans-SNAREs
complexes,图6-11),并通过这个结构将运输小泡的膜与靶膜拉在一起,实现运输小泡特异性停泊和融合。实验证明包含了SNARE的脂质体和包含匹配SNARE的脂质体间可发生融合,尽管速度较慢。这说明除了SNARE之外,还有其他的蛋白参与运输泡与目的膜的融合。
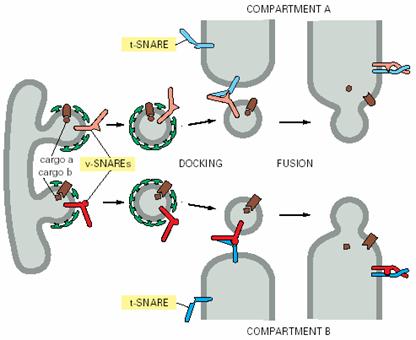
图6-10 t-和v-SNARE引自Molecular Biology of the Cell. 4th ed. 2002
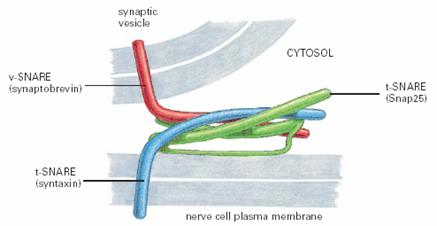
图6-11 SNARE复合体 引自Molecular
Biology of the Cell. 4th ed. 2002
在SNAREs接到新一轮的运输小泡停泊之前,SNAREs必须以分离的状态存在,NSF(N-ethylmaleimide-sensitive fusion protein,
NSF)催化 SNAREs的分离,它是一种类似分子伴娘的ATP酶,能够利用ATP作为能量通过插入几个适配蛋白(adaptor protein)将SNAREs复合体的螺旋缠绕分开(图6-12)。
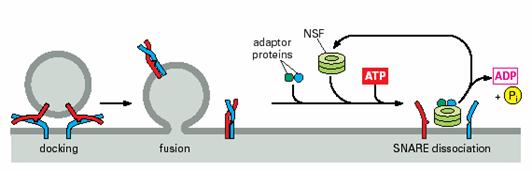
图6-12 SNARE复合体的解离 引自Molecular
Biology of the Cell. 4th ed. 2002
在神经细胞中SNAREs负责突触小泡的停泊和融合,破伤风毒素和肉毒素等细菌分泌的神经性毒素实际上是一类特殊的蛋白酶,能够选择性地降解SNAREs,从而阻断神经传导。
精卵的融合、成肌细胞的融合均涉及SNAREs,另外病毒融合蛋白的工作原理与SNAREs相似,介导病毒与宿主质膜的融合(图6-13)。
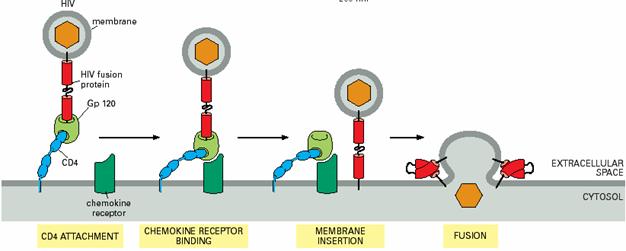
图6-13 病毒融合蛋白的工作原理 引自Molecular
Biology of the Cell. 4th ed. 2002
(二)Rabs
Rab也叫targeting
GTPase,属于单体GTP酶,结构类似于Ras,已知30余种。不同膜上具有不同的Rab,每一种细胞器至少含有一种以上的Rab。Rabs的作用是促进和调节运输小泡的停泊和融合。与衣被召集GTP酶相似的是,起分子开关作用,结合GDP失活,位于细胞质中,结合GTP激活,位于细胞膜、内膜和运输小泡膜上,调节SNAREs复合体的形成。Rabs的调节蛋白与其它G蛋白的相似。Rabs还有许多效应因子(effector),其作用是帮助运输小泡聚集和靠近靶膜,触发SNAREs释放它的抑制因子(图6-14)。许多运输小泡只有在包含了特定的Rabs和SNAREs之后才能形成。
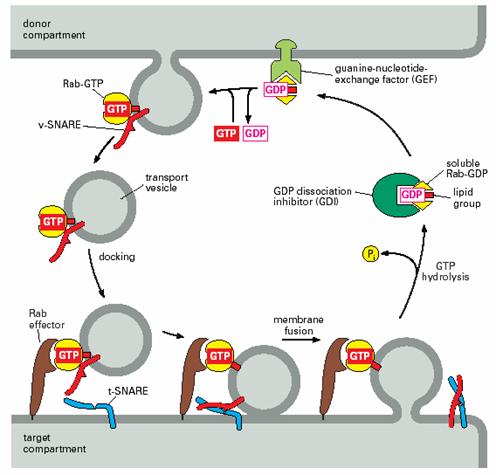
图6-14 Rab的作用 引自Molecular Biology
of the Cell. 4th ed. 2002
四、细胞的内吞与外排
(一)受体介导的内吞
细胞的内吞可分为两类,批量内吞(Bulk-phase endocytosis)和受体介导的内吞(Receptor mediated endocytosis, RME),批量内吞是非特异性的摄入细胞外物质,如培养细胞摄入辣根过氧化物酶。细胞表面的内陷(caveolae)是发生非特异性内吞的部位。
受体介导的内吞作用是一种选择浓缩机制,既可保证细胞大量地摄入特定的大分子,同时又避免了吸入细胞外大量的液体。低密脂蛋白、运铁蛋白、生长因子、胰岛素等蛋白类激素、糖蛋白等,都是通过受体介导的内吞作用进行的。
衣被小窝(coated pits)是质膜向内凹陷的部位,约占肝细胞和成纤维细胞膜表面积的2%。受体大量集中于此处,凹陷的胞质侧具有大量的笼形蛋白和衔接蛋白,类似的结构也存在于高尔基体的TGN区。受体在衣被小窝处的集中与是否结合配体无关。衣被小窝就相当一个分子过滤器(molecular filter),帮助细胞获取所需要的大分子物质。
运输小泡的衣被中,除笼形蛋白外,还有衔接蛋白(adaptin)。它介于笼形蛋白与配体受体复合物之间,起连接作用。衔接蛋白存在有不同的种类,可分别结合不同类型的受体。
跨膜受体蛋白的胞质端有一个由4个氨基酸残基组成的序列(Tyr-X-X-Φ),此序列是发生内吞作用的信号,X表示任何一种氨基酸,Φ为分子较大的疏水氨基酸,如Phe、Leu、Met等,衔接蛋白对此序列有识别能力。
受体同配体结合后启动内化作用,笼形蛋白开始组装。在dynamin的作用下掐断后形成衣被小泡(coated vesicles)。衣被小泡进入胞质后,衣被蛋白随即脱去,分子返回到质膜下方,重又参与形成新的衣被小泡。其过程和高尔基体的TGN区形成溶酶体小泡的过程相似。
胆固醇主要在肝细胞中合成,随后与磷脂和蛋白质形成低密脂蛋白(low-density lipoproteins,LDL),释放到血液中。LDL颗粒的质量为3X106Da,直径20~30nm,芯部含有大约1500个胆固醇分子,这些胆固醇分子被酯化成长链脂肪酸。芯部周围由一脂单层包围,脂单层包含磷脂分子和未酯化的胆固醇以及一个非常大的单链糖蛋白质 (apolipoprotein B-100),这个蛋白质分子可以和靶膜上的受体结合(图6-15)。
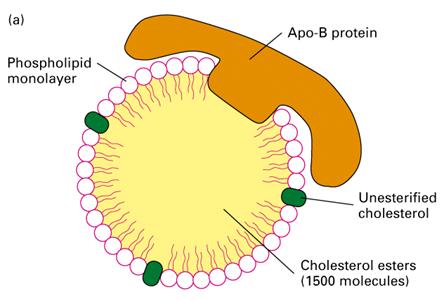
图6-15 LDL的结构
当细胞进行膜合成需要胆固醇时,细胞即合成LDL跨膜受体蛋白,并将其嵌插到质膜中。受体与LDL颗粒结合后,形成衣被小泡;进入细胞质的衣被小泡随即脱掉笼形蛋白衣被,成为平滑小泡,同早期内体融合,内体中PH值低,使受体与LDL颗粒分离;再经晚期内体将LDL送人溶酶体。在溶酶体中,LDL颗粒中的胆固醇酯被水解成游离的胆固醇而被利用(图6-16、17A、18)。细胞对胆固醇的利用具有调节能力,当细胞中的胆固醇积累过多时,细胞即停止合成自身的胆固醇,同时也关闭了LDL受体蛋白的合成途径,暂停吸收外来的胆固醇。有的人因为LDL受体蛋白编码的基因有遗传缺陷,造成血液中胆固醇含量过高(图6-17B),因而会过早地患动脉粥样硬化症(atherosclerosis),这种人往往因易患冠心病而英年早逝。
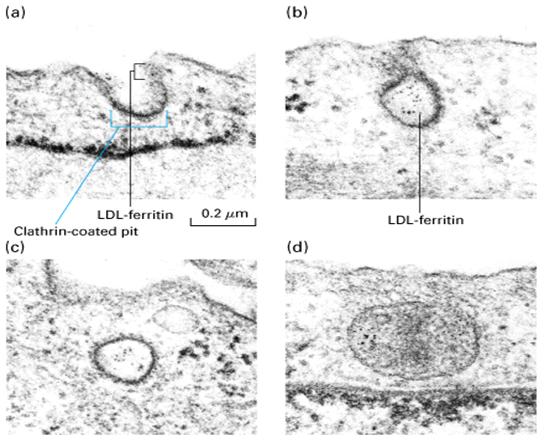
图6-16 LDL的内吞
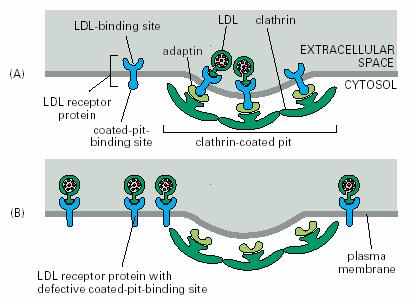
图6-17 clathrin 衣被的组装,异常的受体不能形成包含货物的运输小泡 引自Molecular
Biology of the Cell. 4th ed. 2002
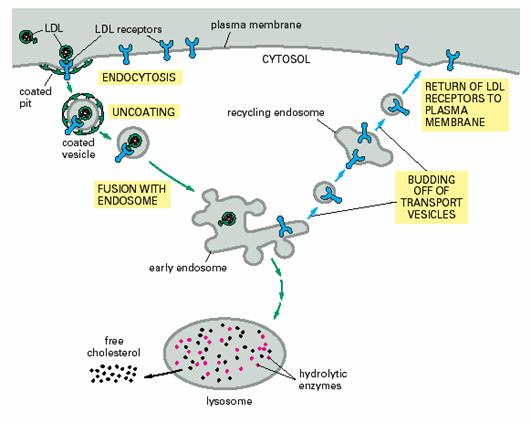
图6-18 受体介导的内吞 引自Molecular Biology
of the Cell. 4th ed. 2002
在受体介导的内吞作用过程中,不同类型的受体具有不同的胞内体分选途径:①大部分受体返回它们原来的质膜结构域,如LDL受体又循环到质膜再利用;②有些受体不能再循环而是最后进入溶酶体,在那里被消化,如与表皮生长因子(epidermal growth factor,EGF)结合的细胞表面受体,大部分在溶酶体被降解,从而导致细胞表面EGF受体浓度降低,称为受体下行调节(receptor down-regulation);③有些受体被运至质膜不同的结构域,该过程称作穿胞运输(transcytosis,图6-19)。在具有极性的上皮细胞,这是一种将内吞作用与外排作用相结合的物质跨膜转运方式,即转运的物质通过内吞作用从上皮细胞的一侧被摄人细胞,再通过外排作用从细胞的另一侧输出。如母鼠的抗体从血液通过上皮细胞进入母乳中,乳鼠肠上皮细胞将抗体摄人体内,都是通过跨细胞的转运完成的。
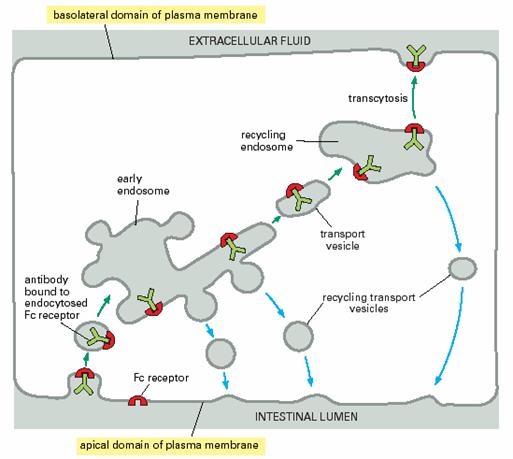
图6-19 穿胞运输 引自Molecular Biology
of the Cell. 4th ed. 2002
(二)外排作用
与细胞的内吞作用相反,外排作用是将细胞内的分泌泡或其他某些膜泡中的物质通过细胞质膜运出细胞的过程。
组成型的外排途径(constitutive exocytosis
pathway):所有真核细胞都有从高尔基体TGN区分泌囊泡向质膜运输的过程,其作用在于更新膜蛋白和膜脂、形成质膜外周蛋白、细胞外基质、或作为营养成分和信号分子。
调节型外排途径(regulated exocytosis pathway):分泌细胞产生的分泌物(如激素、粘液或消化酶)储存在分泌泡内,当细胞在受到胞外信号刺激时,分泌泡与质膜融合并将内含物释放出去。调节型的外排途径存在于特化的分泌细胞。其蛋白分选信号存在于蛋白本身,由高尔基体TGN上特殊的受体选择性地包装为运输小泡。
组成型的外排途径通过default pathway完成蛋白质的转运过程。在粗面内质网中合成的蛋白质除了某些有特殊标志的蛋白驻留在ER或高尔基体中或选择性地进入溶酶体和调节性分泌泡外,其余的蛋白均沿着粗面内质网→高尔基体→分泌泡→细胞表面这一途径完成其转运过程。
|