|
第二节 微管
微管在胞质中形成网络结构,作为运输路轨并起支撑作用。微管是由微管蛋白组成的管状结构,对低温、高压和秋水仙素敏感。
一、分子结构
微管是由13条原纤维(protofilament)构成的中空管状结构(图9-15),直径22~25nm。每一条原纤维由微管蛋白二聚体线性排列而成。微管蛋白二聚体由结构相似的α和β球蛋白构成,两种亚基均可结合GTP,α球蛋白结合的GTP从不发生水解或交换,是α球蛋白的固有组成部分,β球蛋白结合的GTP可发生水解,结合的GDP可交换为GTP,可见β亚基也是一种 G蛋白(图9-16)。
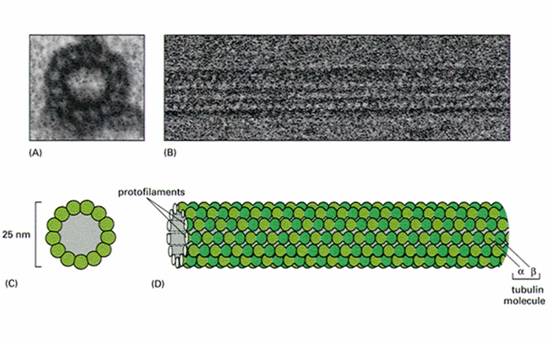
图 9-15 微管纤维
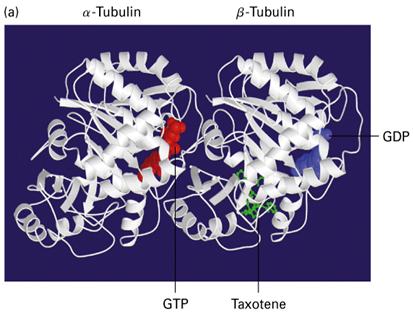
图9-16 微管蛋白分子模型
微管具有极性,(+)极(plus end)生长速度快,(-)极(minus end)生长速度慢,也就是说微管蛋白在(+)极的添加速度高于-极。(+)极的最外端是β球蛋白,(-)极的最外端是α球蛋白。微管和微丝一样具有踏车行为。
微管形成的有些结构是比较稳定的,是由于微管结合蛋白的作用和酶修饰的原因。如神经细胞轴突、纤毛和鞭毛中的微管纤维。大多数微管纤维处于动态的组装和去组装状态,这是实现其功能所必需的过程(如纺锤体)。秋水仙素(colchicine)结合的微管蛋白可加合到微管上,但阻止其他微管蛋白单体继续添加,从而破坏纺锤体结构,长春花碱具有类似的功能。紫杉酚(taxol),能促进微管的装配, 并使已形成的微管稳定。但这种稳定性会破坏微管的正常功能。以上药物均可以阻止细胞分裂,可用于癌症的治疗。
二、微管结合蛋白
微管结合蛋白(microtubule associated proteins MAPs)分子至少包含一个结合微管的结构域和一个向外突出的结构域。突出部位伸到微管外与其它细胞组分(如微管束、中间纤维、质膜)结合(图9-17)。
MAP的主要功能是:①促进微管聚集成束;②增加微管稳定性或强度;③促进微管组装。包括I 型和II型两大类, I 型对热敏感,如MAP1a、 MAP1b,主要存在于神经细胞 。II型热稳定性高,包括 MAP2a、b、c,MAP4和tau蛋白。其中 MAP2只存在于神经细胞,,MAP2a的含量减少影响树突的生长。
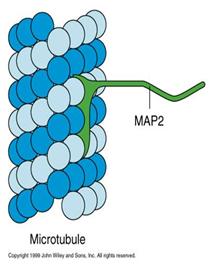
图9-17 MAP2
三、微管组织中心
微管组织中心(microtubule organizing center MTOCs)是微管进行组装的区域,着丝粒、成膜体、中心体、基体均具有微管组织中心的功能。所有微管组织中心都具有γ微管球蛋白,这种球蛋白的含量很低,可聚合成环状复合体,像模板一样参与微管蛋白的核化,帮助α和β球蛋白聚合为微管纤维。
中心体(centrosome)位于细胞的中心部位(图9-18)。由两个相互垂直的中心粒(centriole)构成(图9-19),周围是一些无定形或纤维形、高电子密度的物质,叫做外中心粒物质(PCM,pericentriolar material)。中心粒直径0.2mm,长0.4mm,由9组3联微管构成,不直接参与微管蛋白的核化,具有召集PCM的作用。
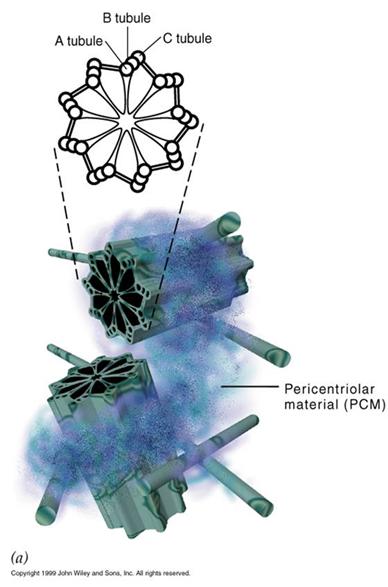
图9-18
中心体结构模型
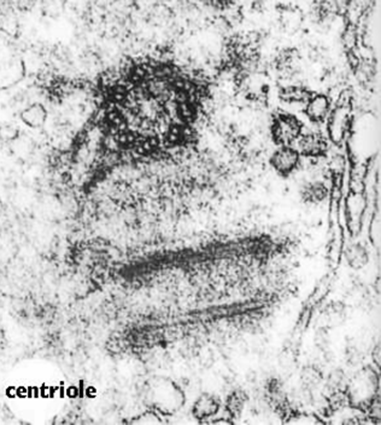
图9-19
中心粒电镜照片
微管蛋白以环状的γ球蛋白复合体为模板核化、先组装出(-)极,然后开始生长,因此中心体周围的微管(-)极指向中心体,(+)级远离中心体。
1972年R. Weisenberg证明提纯的微管,在微酸性环境(PH=6.9),适宜的温度下,存在GTP、Mg2+和去除Ca2+的条件下能自发的组装成微管。但这种微管只有11条原纤维,可能是因为没有γ微管球蛋白构成的模板。
微管β球蛋白结合的GTP水解并不是微管组装所必需的步骤,但是结合GTP的微管蛋白二聚体能加合到微管纤维上,在快速生长的纤维两端微管球蛋白结合的GTP来不及水解,形成的“帽子”,使微管纤维较为稳定。一旦暴露出结合GDP的亚单位微管,则开始去组装。
四、微管的功能
1、支架作用
细胞中的微管就像混凝土中的钢筋一样,起支撑作用,在培养的细胞中,微管呈放射状排列在核外,(+)端指向质膜(图9-20),形成平贴在培养皿上的形状。在神经细胞的轴突和树突中,微管束沿长轴排列,起支撑作用,在胚胎发育阶段为管帮助轴突生长,突入周围组织,在成熟的轴突中,微管是物质运输的路轨。
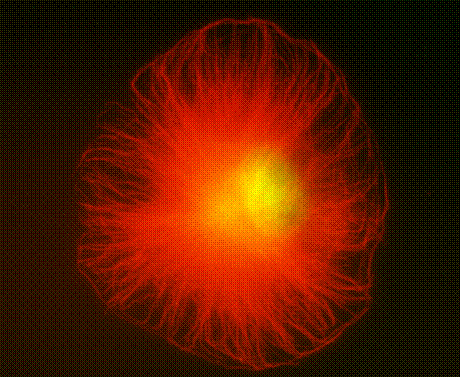
图9-20 以细胞核为中心向外放射状排列的微管纤维(红色)图片来自http://www.itg.uiuc.edu/
2、细胞内运输
微管起细胞内物质运输的路轨作用,破坏微管会抑制细胞内的物质运输。
与微管结合而起运输作用的马达蛋白有两大类:驱动蛋白kinesin,动力蛋白dynein,两者均需ATP提供能量。
Kinesin发现于1985年,是由两条轻链和两条重链构成的四聚体(图9-21),外观具有两个球形的头(具有ATP酶活性)、一个螺旋状的杆和两个扇子状的尾。通过结合和水解ATP,导致颈部发生构象改变,使两个头部交替与微管结合,从而沿微管“行走”,将“尾部”结合的“货物”(运输泡或细胞器)转运到其它地方。据估计哺乳动物中类似于kinesin的蛋白(KLP, kinesin-like protein or KRB, kinesin-related
protein)超过50余种,大多数KLP能向着微管(+)极运输小泡,也有些如Ncd蛋白(一种着丝点相关的蛋白)趋向微管的(-)极。
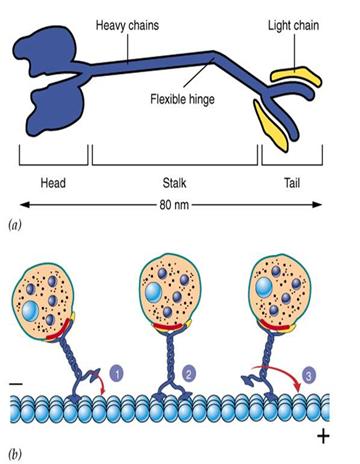
图9-21 Kinesin
Dynein发现于1963年,因与鞭毛和纤毛的运动有关而得名。dynein分子量巨大(接近1.5Md),由两条相同的重链和一些种类繁多的轻链以及结合蛋白构成(鞭毛二联微管外臂的动力蛋白具有三个重链)。其作用主要有以下几个方面:在细胞分裂中推动染色体的分离、驱动鞭毛的运动、向着微管(-)极运输小泡(图9-22)。
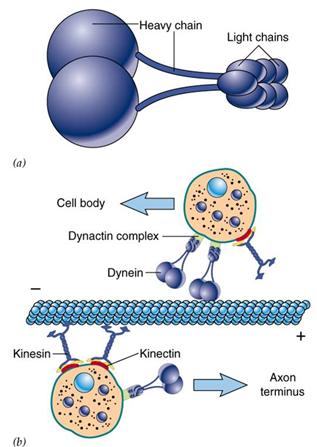
图 9-22 Dynein (图片来自
G. Karp 2002)
3、形成纺锤体
纺锤体是一种微管构成的动态结构,其作用是在分裂细胞中牵引染色体到达分裂极,详细内容参见第十三章。
4、纤毛与鞭毛的运动
纤毛与鞭毛是相似的两种细胞外长物,前者较短,约5~10um;后者较长,约150um,两者直径相似,均为0.15~0.3um。
鞭毛和纤毛均由基体和鞭杆两部分构成(图9-23),鞭毛中的微管为9+2结构,即由9个二联微管和一对中央微管构成,其中二联微管由AB两个管组成,A管由13条原纤维组成,B管由10条原纤维组成,两者共用3条。A管对着相邻的B管伸出两条动力蛋白臂(图9-24),并向鞭毛中央发出一条辐。基体的微管组成为9+0,并且二联微管为三联微管所取代,结构类似于中心粒。
纤毛和鞭毛的运动是依靠动力蛋白(dynein)水解ATP,使相邻的二联微管相互滑动。有一种男性不育症是由于精子没有活力造成的。这种病人同时还患有慢性支气管炎,主要是因为是鞭毛和纤毛没有动力蛋白臂,不能排出侵入肺部的粒子。
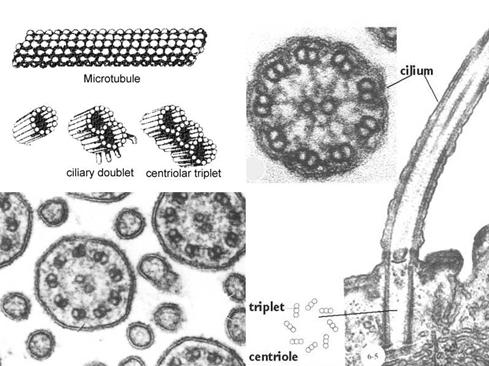
图9-23
鞭毛的结构
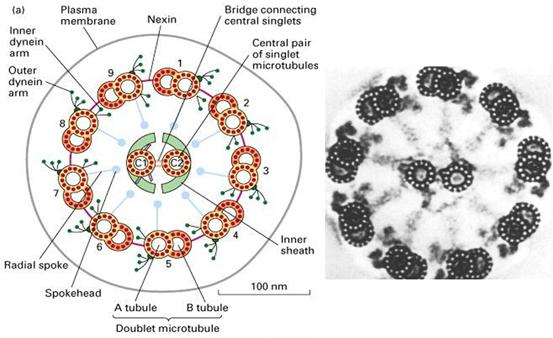
图9-24
鞭毛轴丝结构 |