|
第三节 病毒与蛋白质感染因子
病毒(Virus)是一类非细胞形态的介于生命与非生命形式之间的物质。有以下主要特征:①个体微小,可通除滤菌器,大多数必须用电镜才能看见;②仅具有一种类型的核酸,或DNA或RNA,没有含两种核酸的病毒;③专营细胞内寄生生活;④具有受体连结蛋白(receptor binding protein),与敏感细胞表面的病毒受体连结,进而感染细胞。
一、病毒的形态和结构
病毒的大小一般在10~30nm之间。结构简单,由核酸(DNA或RNA)芯和蛋白质衣壳(capsid)所构成,称核衣壳(nucleocapsid),衣壳有保护病毒核酸不受酶消化的作用。各种病毒所含的遗传信息量不同,少的只含有3个基因,多的可达300个不同的基因。
病毒衣壳由一至几种蛋白组成,组成病毒衣壳的亚单位称壳微粒(capsomer)。病毒的形成不需要酶的参加,只要条件具备,核酸和蛋白质便可自我装配(self assembly)成病毒。其装配形式有二十面体对称、螺旋对称和复合对称三种类型。二十面体对称型的衣壳蛋白形成二十面体,核酸包在其中;螺旋对称型的衣壳蛋白与核酸呈螺旋形排列,核酸交织在其中;复合对称型为同时具有或不具有两种对称性形式的病毒(图3-21)。
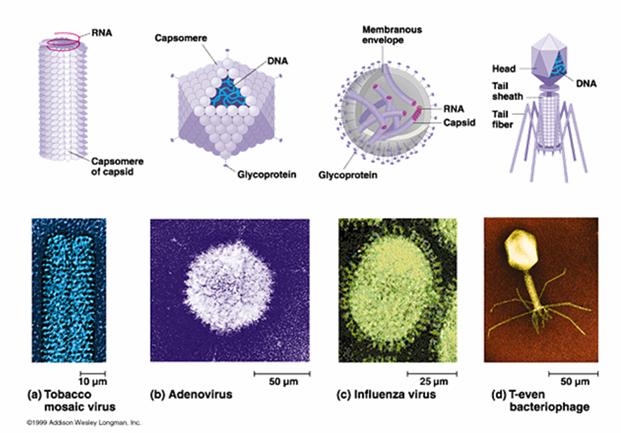
图3-21
病毒衣壳的排列方式
一个成熟有感染性的病毒颗粒称“病毒体”(Virion)。电镜观察有五种形态;①球形(Sphericity):大多数人类和动物病毒为球形,如脊髓灰质炎病毒(图3-21)、疱疹病毒及腺病毒等;②丝形(Filament):多见于植物病毒,如烟草花叶病病毒(图3-22),人类流感病毒有时也是丝形;③弹形(Bullet-shape):形似子弹头,如狂犬病毒、疱疹性口炎(图3-23)病毒等,其他多为植物病毒。④砖形(Brick-shape):如天花病毒(图3-24)、牛痘苗病毒等;⑤蝌蚪形(Tadpole-shape):由一卵圆形的头及一条细长的尾组成,如噬菌体(图3-25)。其中①为二十面体对称;②、③为螺旋对称;④、⑤为复合对称。
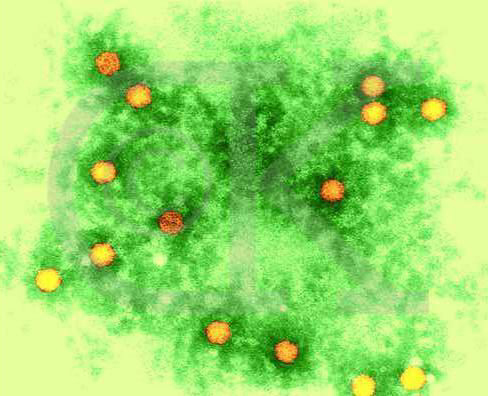
图3-21 脊髓灰质炎病毒。图片来自http://www.denniskunkel.com/
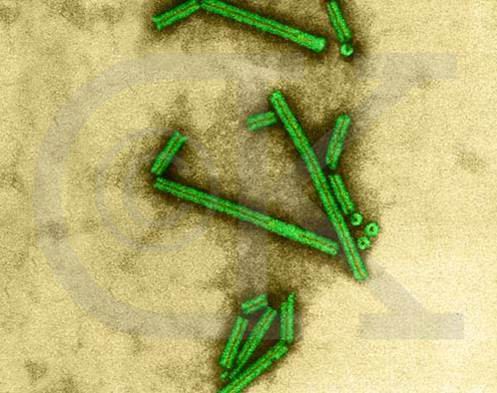
图3-22 烟草花叶病毒。图片来自http://www.denniskunkel.com/
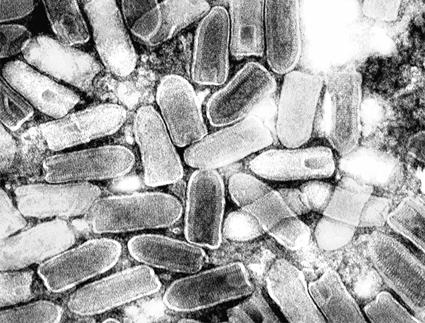
图3-23 疱疹性口炎(vesicular stomatitis)病毒,形态与狂犬病毒相似,均为子弹形。图片来自http://www.vetmed.ucdavis.edu
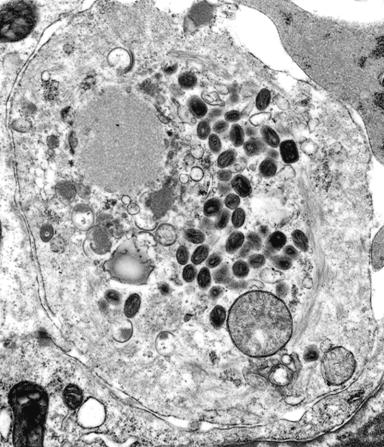
图3-24人类天花病毒(图中深染的颗粒)。图片来自http://www.vetmed.ucdavis.edu
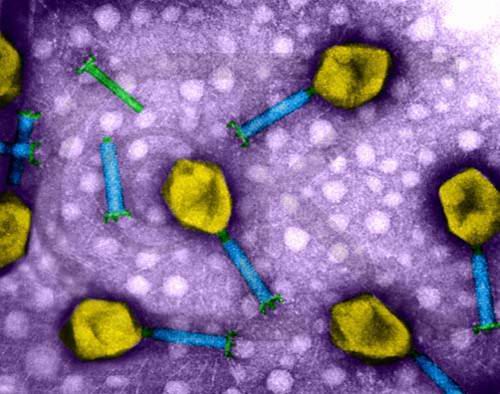
图3-25 T4噬菌体。 图片来自http://www.denniskunkel.com/
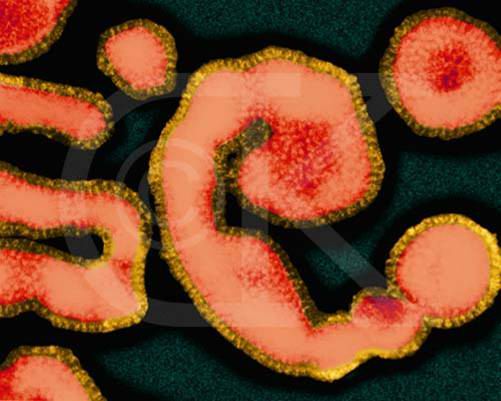
图3-26 丝状有被膜的病毒(流感冒病毒)。图片来自http://www.denniskunkel.com/
有的病毒衣壳外面尚有一层被膜(viral envelope,图3-26),这层被膜是病毒粒子脱离细胞时,包被上的宿主细胞的质膜,被膜中含有病毒融合蛋白(viral fusion protein),如流感病毒。病毒融合蛋白在病毒进入宿主细胞时起着关键作用。
病毒只有在侵入细胞以后才表现出生命现象。病毒的生活周期可分为两个阶段:一个是细胞外阶段,以成熟的病毒粒子形式存在;另一个是细胞内阶段,即感染阶段,在此阶段中进行复制和繁殖。感染阶段开始时,病毒的遗传物质由衣壳中释放出来,注入宿主细胞中,然后在病毒核酸信息的指导控制下,形成新的病毒粒子。
根据寄生的宿主不同,病毒可分为动物病毒、植物病毒和细菌病毒(即噬菌体)三大类。根据病毒所含的核酸的性质和状态不同,可将病毒分为6类:
1)
双链±DNA→+mRNA→蛋白质,如天花病毒、T-偶数噬菌体。
2)
单链+DNA→±DNA→+RNA→蛋白质。
3)
双链±RNA→+mRNA→蛋白质,如呼肠孤病毒。
4)
单链+RNA→-RNA→+RNA→蛋白质脊髓灰质炎病毒。
5)
单链-RNA→+RNA→+蛋白质,如流感病毒、副流感病毒、狂犬病毒。
6)
单链+RNA→DNA→±DNA→+mRNA→蛋白质,即逆转录病毒(retrovirus)又称RNA肿瘤病毒(oncornavirus)。
二、类病毒
类病毒在结构上比病毒还要简单,没有蛋白质外壳,仅为一裸露的RNA分子。由于它们具有感染作用,类似于病毒,故称为类病毒(viroid)。它们不能像病毒那样感染细胞,只有当植物细胞受到损伤,失去了膜屏障,它们才能在供体植株与受体植株间传染。例如,马铃薯锤管类病毒仅由一个含359个核苷酸的单链环状RNA分子组成,链内有一些互补序列。分子长约40~50nm,不能制造衣壳蛋白。
三、病毒的进化地位
无论是病毒还是类病毒都不具有独立进行生物合成的能力,它们都是细胞的寄生物,因此在进化上病毒的出现不可能早于细胞。病毒的前身很可能是在宿主染色体外独立进行复制的质粒(plasmid)。质粒既有DNA型的,也有RNA型的。它与病毒相似之处主要在于,它具有专一的核苷酸序列作为复制的起始部位。但它又不同于病毒,不能制造蛋白质外壳,不能像病毒一样从一个细胞传递到另一个细胞。当DNA质粒获得了为衣壳蛋白质编码的基因时,即意味着病毒出现了。
病毒能在种间传递核酸序列,因而它在生物进化上起着重要作用。由于病毒核酸往往可同宿主染色体重组,所以病毒核酸就有可能连接上一小段宿主染色体,一同传递到另一种细胞或有机体中。更有甚者,病毒DNA整合到宿主染色体中,变成了宿主基因组的一部分,这部分DNA称为前病毒(provirus)。通过病毒在宿主细胞基因组间传递DNA序列的过程称为DNA转导(DNA transduction)。在生物工程和分子生物学研究中常通过这种途径来转导目的基因。病毒的某些属性在细胞的生命活动中也具有普遍意义,通过对病毒活动的研究有助于对生命现象的理解。例如:
1.
自我装配。病毒成分有限,结构简单,但只要成分齐备,条件适宜,即可自动装配成有活性的病毒。
2.
装配信息来自分子本身。
3.
遗传密码的统一性。病毒和细胞携带的遗传物质是相同的,使用了同一套遗传密码。
4.
自我复制。病毒进入细胞后,能够自我复制和繁殖,具有生命特征。
四、蛋白质感染因子
1982年S.B.Prusiner以叙利亚仓鼠为实验材料,发现羊瘙痒病(scrapie)的病原体是一种蛋白质,不含核酸,命名为prion,意即PROteinnaceous Infection ONly,译为蛋白质感染因子或朊病毒,Prusiner因此项发现更新了医学感染的概念,获1997年的诺贝尔生理与医学奖。
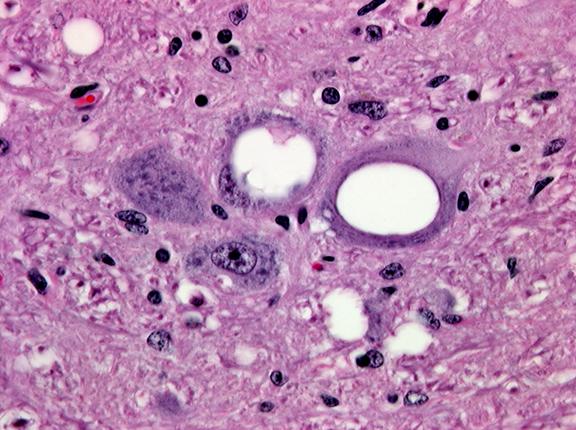
图3-27病羊神经组织的海绵状损伤 图片来自http://www.vetmed.ucdavis.edu
羊瘙痒病发现已有200年的历史,羊得了这种病就会浑身发痒,不断在坚硬物质上搓擦身体,最后死亡。它是一类传染性海绵状脑病(transmissible spongiform encephalopathies,TSE)。疯牛病,即牛海绵状脑病(bovine spongiform encephalopathy,BSE)也属于此类疾病,发现于1986年,是由于牛被喂以由死羊骨粉制造的饲料而被感染,病牛脑内灰质及神经元都有典型的海绵状退化(图3-27、28),出现淀粉样(amyloid)蛋白沉淀(图3-28),与羊瘙痒病相似。同类型的prion也会使鹿、貂及猴子患病,人类也具有类似的疾病。
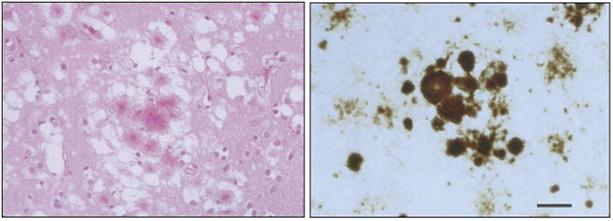
图3-28
vCJD病人大脑组织切片,左、海绵状病变及周围的沉淀斑,右、淀粉样蛋白沉淀,短线表示50um。引自Stanley B. Prusiner 1997
Prion是一种结构变异的蛋白质,对高温和蛋白酶均具有较强的抵抗力。它能转变细胞内的此类正常的蛋白PrPC(cellular prion protein),使PrPC发生结构变异,变为具有致病作用的PrPSc(scrapie-associated prion protein)。
PrPC存在于神经元、神经胶质细胞和其它一些细胞,属于糖磷脂酰肌醇锚定蛋白,集中在膜上的脂筏中,对蛋白酶和高温敏感,可能和细胞信号转导有关。
PrPSc与PrPc的一级结构相似(图3-29),均由253-4个氨基酸组成,分子量约33-37KD。纯化的Prion经傅里叶变换红外光谱分析,发现PrPc的高级结构中具有43%的α螺旋,极少的β折叠(3%),而PrPsc具有34%α螺旋,43%的β折叠。动物被感染后,发生错误折叠的PrPSc蛋白堆积在脑组织中,形成不溶的淀粉样蛋白沉淀,无法被蛋白酶分解,引起神经细胞凋亡(Apoptosis)。
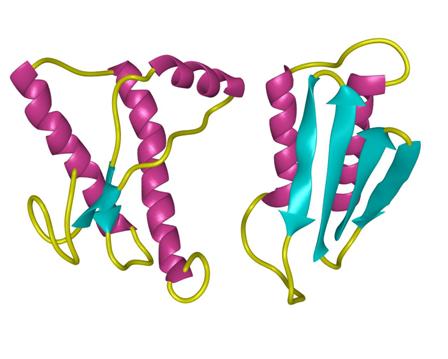
图3-29 Prion的结构模型,左PrPc,右PrPSc 图片来自http://www.cmpharm.ucsf.edu/cohen/media/pages/gallery.html
编码PrP蛋白的基因称为Prnp,该基因位于人第20号染色体的短臂,小鼠第2号染色体。敲除小鼠的Prnp基因,小鼠仍能正常发育,并对瘙痒病完全免疫,但出生后很快会出现共济失调、小脑皮层颗粒细胞退化。
目前对蛋白质感染因子的增殖方式有两种解释(图3-30),一是重折叠模型(refolding model),认为PrPSc分子起分子伴侣(molecular
chaperone)的作用,能与PrPc分子相结合,诱使PrPc转变成PrPSc,从而形成了PrPSc二聚体,于是一个PrPSc分子就变成了2个PrPSc分子,如此倍增不已。另一种解释是晶种模型(Seeding model),认为PrPc分子本身有向PrPSc转变的倾向(一种平衡反应),PrPSc能像晶种一样,稳定PrPc的构象,形成淀粉样蛋白沉淀,然后碎裂后又变成新的晶种。
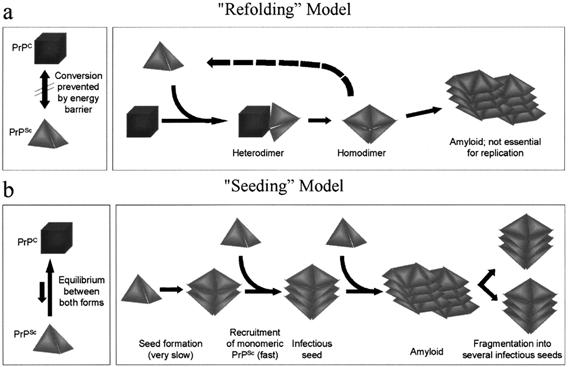
图3-30 PrPSc的增殖 图片引自Frank
L. Heppner等2001
蛋白质感染因子的增殖既不是由于基因过分表达,也不是因翻译量增加,而是由于正常分子的构象发生转变造成的,所以亦称朊病毒。目前已知的人类PRION疾病主要有:
1.
克-雅二氏病(Creutzfeldt–Jakob
disease,CJD):Cruetzfeldt和Jakob 1920年发现于六例患者,大多发生于60岁以上的人,是自身PrP蛋白发生变异引起的。
2.
变异型克-雅氏病(vCJD):患者都处于以往CJD未曾出现的年龄段,为十几岁至三十岁的年轻人,是由于取食病牛产品而感染。患者首先出现忧郁症的病状,继而不能行走,并呈现精神障碍等痴呆症状,最后死亡。
3.
GSS综合征(Gerstmann-Straussler Scheinker disease)):是一种遗传的的慢性脑病,由Prnp基因缺陷引起,PrP蛋白的102位亮氨酸被脯氨酸取代或117位的缬氨酸被丙氨酸取代。
4.
克鲁病(Kuru):发现于新几内亚一个叫Fore的部落,当地人称作kuru,意即颤抖。病人大多数是妇女及小孩,病症有言语含糊及无意识地狂笑,最后不省人事并死亡。一名美国医生D. C. Gajdusek到了当地,发现那里的妇女及小孩具有吃死者尸体的习惯,结果受到感染。
5.
致死性家族性失眠症(Fatal familial
insomnia,FFI):也是一种遗传性疾病,Prnp基因变异,PrP蛋白178位的天冬酰胺被天冬氨酸取代。患者的主要症状是失眠,并有CJD的症状。
对于蛋白质感染因子引起的疾病,目前尚没有有效的治疗措施。这类蛋白具有很强的抵抗力,对抗生素和消毒剂不敏感,134-138℃持续1h的病牛脑组织匀浆,以及10%福尔马林固定过的病羊脑组织,仍有感染性。
据报道,自1996年以来,共有106人得了疯牛病,其中仅有七人还活着。
|