|
第四节 细胞培养与细胞杂交
一、细胞培养
高等生物是由多细胞构成的整体,在整体条件下要研究单个细胞或某一群细胞在体内(in vivo)的功能活动是十分困难的。但是如果把活细胞拿到体外(in vitro)培养进行观察和研究,则要方便得多。活细胞离体后要在一定的生理条件下才能存活和进行生理活动,特别是高等动植物细胞要求的生存条件极其严格,稍有不适就要死亡。所以细胞培养技术(cell culture)就是选用最佳生存条件对活细胞进行培养和研究的技术。
动物细胞的生存环境与植物细胞差别很大,因而二者的培养方法很不相同。
(一)动物细胞培养
细胞培养方式大致可分为两种(图2-25):一种是群体培养(mass culture),将含有一定数量细胞的悬液置于培养瓶中,让细胞贴壁生长,汇合(confluence)后形成均匀的单细胞层;另一种是克隆培养(clonal culture),将高度稀释的游离细胞悬液加入培养瓶中,各个细胞贴壁后,彼此距离较远,经过生长增殖每一个细胞形成一个细胞集落,称为克隆(clone)。一个细胞克隆中的所有细胞均来源于同一个祖先细胞。此外,为了制取细胞产品而设计了转鼓培养法,使用大容量的圆培养瓶,在培养过程中不断地转动,使培养的细胞始终处于悬浮状态之中而不贴壁。
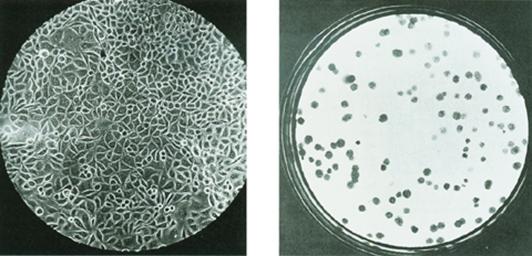
图2-25
群体培养(左)和克隆培养(右)
表2-3 目前实验室中常用的几种细胞系
| 细胞系名称 |
细胞类型 |
来源 |
| 3T3 |
成纤维细胞 |
小鼠 |
| HeLa |
宫颈癌上皮细胞 |
人 |
| BHK21 |
成纤维细胞 |
叙利亚仓鼠 |
| PtKl |
上皮细胞 |
袋鼠 |
| L6 |
成肌细胞 |
大鼠 |
| PCI2 |
嗜铬细胞 |
大鼠 |
| SP2 |
浆细胞 |
小鼠 |
| SP2/0 |
骨髓瘤浆细胞 |
小鼠 |
| CHO |
卵巢细胞 |
中国地鼠 |
正常细胞培养的世代数有限,如人胚成纤维细胞可传30-50代,相当于150-300个细胞增殖周期。癌细胞和发生转化的细胞则能无限培养下去,所谓转化即是指正常细胞在某种因子的作用下发生突变而具有癌性的细胞。目前世界上许多实验室所广泛传用的HeLa细胞系就是1951年从一位名叫Henrietta Lacks的妇女身上取下的宫颈癌细胞培养而成,此细胞系一直延用至今。
原代培养(primary
culture):也叫初代培养,指直接从体内取出的细胞、组织和器官进行的第一次的培养物。一旦已进行传代培养(subculture)的细胞,便不再称为原代培养,而改称为细胞系。
传代(passage):将细胞从一个培养瓶转移到另外一个培养瓶即称为传代或传代培养。培养细胞的“一代”,不表示细胞分裂一次,而是指培养细胞从接种到再次转移培养的过程。在一次传代培养中,细胞能倍增3-6次。
细胞系(cell
line):原代培养物成功传代后,则称之为细胞系。如细胞系的生存期有限,则称之为有限细胞系(finite
cell line);已获无限繁殖能力能持续生存的细胞系,称连续细胞系或无限细胞系(infinite
cell line)。无限细胞系大多已发生异倍化,具异倍体核型,有的可能已成为恶性细胞,因此本质上已是发生转化的细胞系。无限细胞系有的只有永生性(或不死性),但仍保留接触抑制和无异体接种致癌性;有的不仅有永生性,异体接种也有致瘤性
。
细胞株(cell
strain):通过选择法或克隆形成法从原代培养物或细胞系中获得具有特殊性质或标志物称为细胞株。细胞株的特殊性质或标志必须在整个培养期间始终存在。再由原细胞株进一步分离培养出与原株性状不同的细胞群,亦可称之为亚株(substrain)。
克隆(clone):亦称无性繁殖系或简称无性系。对细胞来说,克隆是指由同一个祖先细胞通过有丝分裂产生的遗传性状一致的细胞群。
二倍体细胞(diploid
cells):染色体数目与原供体二倍细胞染色体数相同或基本相同(2n细胞占75%或80%以上)的细胞群。二倍体细胞在正常情况下具有限生命期,故属有限细胞系。
(二)植物细胞培养
植物细胞培养主要有如下几种技术:
1.
组织培养:诱发产生愈伤组织(图2-26),如果条件适宜,可培养出再生植株。用于研究植物的生长发育、分化和遗传变异;进行无性繁殖;制取代谢产物。
2.
悬浮细胞培养:在愈伤组织培养技术基础上发展起来的一种培养技术。适合于进行产业化大规模细胞培养,制取植物代谢产物。
3.
原生质体培养:脱壁后的植物细胞称为原生质体(protoplast),其特点是:①比较容易摄取外来的遗传物质,如DNA;②便于进行细胞融合,形成杂交细胞;③与完整细胞一样具有全能性,仍可产生细胞壁,经诱导分化成完整植株:
4.
单倍体培养:通过花药或花粉培养可获得单倍体植株,经人为加倍后可得到完全纯合的个体。
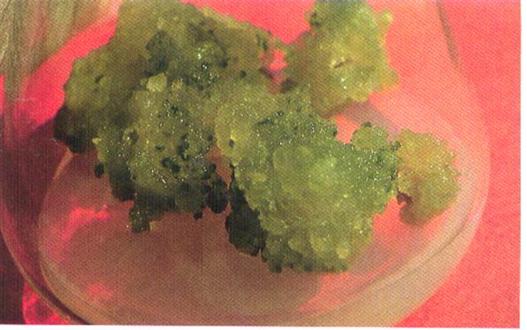
图2-26
植物细胞培养
二、细胞融合
通过培养和诱导,两个或多个细胞合并成一个双核或多核细胞的过程称为细胞融合(cell
fusion)或细胞杂交(cell
hybridization)。
基因型相同的细胞融合成的杂交细胞称为同核体(homokaryon);来自不同基因型的杂交细胞则称为异核体(heterokaryon)。
同种细胞在培养时2个靠在一起的细胞自发合并,称自发融合;异种间的细胞必须经诱导剂处理才能融合,称诱发融合。
诱导细胞融合的方法有三种:生物方法(病毒)、化学方法(聚乙二醇PEG)、物理方法(电激和激光)。某些病毒如:仙台病毒、副流感病毒和新城鸡瘟病毒的被膜中有融合蛋白(fusion
protein),可介导病毒同宿主细胞融合,也可介导细胞与细胞的融合,因此可以用紫外线灭活的此类病毒诱导细胞融合。化学和物理方法可造成膜脂分子排列的改变,去掉作用因素之后,质膜恢复原有的有序结构,在恢复过程中便可诱导相接触的细胞发生融合。
细胞融合不仅可用于基础研究,而且还有重要的应用价值,在植物育种方面已经成功的有萝卜+甘蓝、粉蓝烟草+郎氏烟草、番茄+马铃薯等等。
单克隆抗体技术是细胞杂交技术的成功应用,正常B淋巴细胞(如小鼠脾细胞)具有分泌特异抗体的能力,但不能在体外长期培养,瘤细胞(如骨髓瘤)可以在体外长期培养,但不分泌特异抗体。于是英国人Kohler和Milstein
1975将两种细胞杂交而创立了单克隆抗体技术,获1984年诺贝尔奖。
人工诱导小鼠脾细胞和骨髓瘤细胞融合后,细胞将以多种形式出现,如脾细胞-瘤细胞、脾细胞-脾细胞、瘤细胞-瘤细胞、细胞多聚体、未融合的脾细胞和瘤细胞等,其中只有脾细胞-瘤细胞的融合体是有用的。正常的脾细胞在培养基中存活仅5-7天,无需特别筛选,细胞多聚体形也容易死去,关键问题是要去除未融合的瘤细胞。选择培养基具有3种关键成分:次黄嘌呤(hypoxanthine)、氨甲蝶呤(aminopterin)和胸腺嘧啶核苷(thymidine),故名HAT培养基。这个培养基通过抑制瘤细胞的核苷酸合成,达到去除未融合瘤细胞的目的。细胞有两条基本途径合成嘌呤核苷酸,一条是从磷酸核糖、氨基酸、CO2和NH3等化合物开始,叶酸是重要的辅酶,而氨甲蝶呤是叶酸的拮抗剂,可阻断瘤细胞通过这一途径合成核苷酸。另一条途径是利用已存在的碱基,经特异的磷酸核糖转移酶催化合成核苷酸,如次黄嘌呤经过次黄嘌呤磷酸核糖转移酶(HGPRT)转变为嘌呤核苷酸。融合所用的瘤细胞是选择出来的HGPRT缺陷细胞株,因此不能在HAT培养基中生长,而且不合成或不分泌免疫球蛋白。只有融合细胞具有亲代双方的遗传性能,可在HAT培养基中长期存活与繁殖并分泌抗体。杂交瘤细胞选择成功后,还需要将细胞稀释为单个培养,用ELISA法鉴定和选择高分泌特异抗体的杂交瘤克隆(图2-27)。
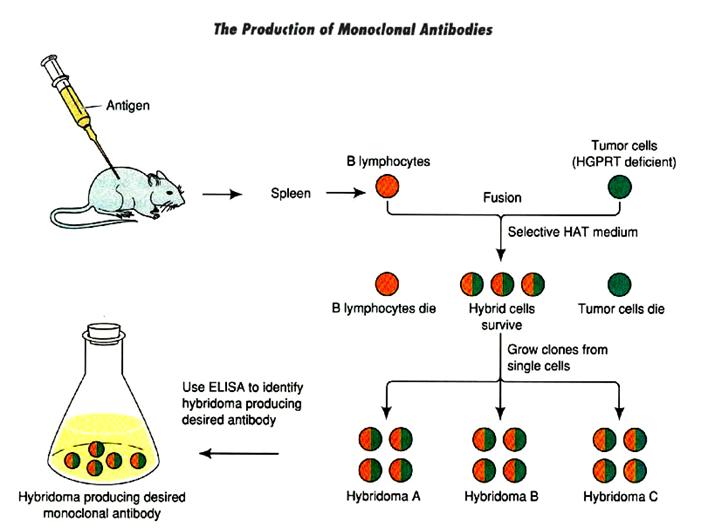
图2-27
单克隆抗体技术
|